В начале года китайские генетики объявили об успешном клонировании макаки-резус — одного из самых разумных и близких нам животных. Ученые полны энтузиазма: макаки идеальны для изучения человеческих заболеваний и тестирования разных лекарств — например, от Альцгеймера. Зоозащитники категорически против: в ходе таких испытаний десятки особей умирают в мучениях. Мы изучили аргументы обеих сторон и попытался разобраться, что важнее: благополучие животных или польза для человека.
Как и зачем мы клонируем животных
В начале этого года в журнале Nature Communications вышла громкая статья: группа ученых из Китая отчиталась об успешном клонировании макаки-резус — не просто высокоразвитого животного, а одного из самых близких генетических родственников человека. «Нам удалось получить первого живого и здорового клона макаки-резус. Это огромный шаг вперед, он сделал невозможное возможным», — в разговоре с «Новой газетой Европа» авторы исследования, генетики Фалонг Лу, Чжень Лю и Цян Сунь не скрывают гордости. Раньше эксперименты по созданию одной макаки-резус из клетки другой заканчивались неудачно. «Результат всех предыдущих попыток — ноль здоровых клонов», — подчеркивают китайские исследователи. Сначала они не спешили публиковать результаты своего эксперимента, но в январе 2024 года, когда клону исполнилось почти три года, поняли, что пора объявить об успехе.
Клонирование макаки-резус произвело особый фурор в области медицинских исследований: из-за схожей физиологии приматов широко используют для изучения людских болезней и лекарств. А испытания на генетически идентичных особях — залог максимально точных результатов. Но зоозащитники, которые традиционно выступают против клонирования, в очередной раз осудили ученых: они считают, что потенциальная польза для человечества не стоит страданий животных.
Вкратце спор между сторонниками и противниками клонирования животных сводится к вопросу о том, что важнее: благополучие животных или научный прогресс? Мы решили разобраться, как и зачем мы учимся клонировать живых существ.
Клоны среди нас
Клонирование — это форма размножения, зародившаяся совсем не в лаборатории. В природе такое происходит постоянно. Почкование у растений и губок, разбрасывание спор у грибов, даже просто деление организма на части, как у червей или морских звезд, — всё это виды бесполого размножения, при котором организм создает собственные копии. Бактерии, насекомые и некоторые ракообразные тоже размножаются клонально, передавая потомству идентичный набор генов.
Человек давно научился использовать способность некоторых организмов клонировать самих себя: например, мы копируем вегетативное размножение у растений. Сообразив, что побеги материнского растения, отделившись, могут развиться в новый полноценный организм, мы стали разводить их сами. Оказалось, достаточно взять от растения фрагмент — черенок, клубень, луковицу — и из него вырастет копия оригинала.
Клоны встречаются и среди более развитых животных, которые размножаются половым путем, — среди людей и других млекопитающих. Здесь репродуктивный механизм устроен иначе: половые клетки двух особей сливаются и случайным образом перетасовывают свои ДНК, образуя единую клетку со смешанным набором родительских генов. Результат — оплодотворенная яйцеклетка, она же зигота. Зигота затем развивается в эмбрион, давая начало новому организму с собственным уникальным геномом.
При половом размножении клоны возникают именно на стадии формирования зародыша: иногда зигота разделяется, и из каждой части независимо друг от друга развиваются два или более эмбрионов. Тогда на свет появляются монозиготные (или однояйцевые) близнецы. Их ДНК, как и у всех детей, отличаются от родительских, но совпадают друг с другом почти на 100%. Такое происходит примерно в 1 случае из 250.
Именно эту особенность репродуктивного процесса млекопитающих взяли на вооружение первые ученые, которые заинтересовались клонированием. В конце 19 века немецкие биологи изучали развитие эмбрионов и выяснили, что зиготу, например, морского ежа достаточно просто встряхнуть, чтобы расщепить ее надвое. Из обоих бластомеров (так называются клетки, на которые дробится зигота на ранних стадиях) выросло по полноценному морскому ежу, и стало ясно, что каждый бластомер содержит полный набор генетических инструкций для развития организма.
Эксперименты с намеренным делением зиготы продолжились, и вскоре немецкому эмбриологу Хансу Шпеману удалось создать клонов позвоночного животного — саламандры. На этот раз расщепить бластомеры оказалось сложнее: для этого ученому понадобилась петля, сделанная из детского волоса.
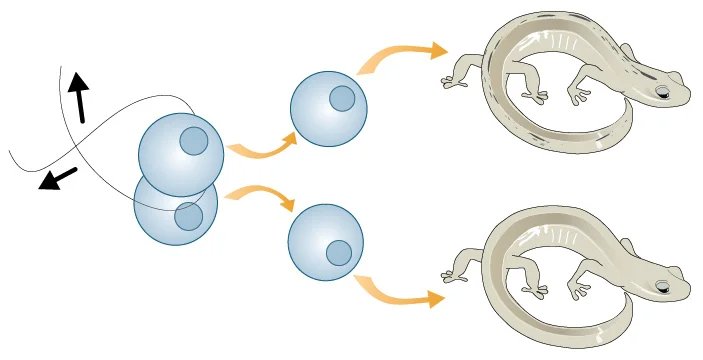
Зигота саламандры расщеплялась сложнее. Учёным пришлось «помочь» ей при помощи волоска. Иллюстрация: Teach.Genetics
Тем не менее, метод доказал свою эффективность и с тех пор клонирование через физическое расщепление зиготы широко применяется, например, у домашнего скота. Что касается человеческих эмбрионов, их дробление на ранней стадии и заморозка могли бы повысить шансы на беременность для пар, которые прибегают к ЭКО. Такие предложения уже звучат и даже одобряются — например, этическим комитетом Американского общества репродуктивной медицины. В конце концов, искусственное удваивание потомства в пробирке технически мало чем отличается от того, как природа создает однояйцевых близнецов.
Первые шаги
Однако в случае с высокоразвитыми животными такая техника клонирования дает возможность наделать копии эмбрионов особи, но не клонировать саму особь. Так как же скопировать уже существующий организм? Как получить клона только от одного «родителя», минуя половое размножение? Ученые бились дальше.
В конце 1950-х британскому биологу Джону Гёрдону удалось клонировать лягушку, не прибегая к естественному размножению. Он воспользовался наработками коллег, которые к тому моменту уже научились переносить клеточные ядра (именно они содержат ДНК и направляют развитие организма) из одной клетки в другую. Гёрдона интересовали соматические клетки — так называют все клетки тела, кроме половых: сперматозоидов и яйцеклеток. В отличие от половых клеток, которые несут только по половине хромосомного набора, соматические клетки содержат полный комплект хромосом, то есть исчерпывающую информацию о том, как построить организм. Но при этом они не могут зачать новую жизнь — на это способны только половые клетки.
Чтобы обойти это препятствие, Гёрдон попробовал перенести ядро соматической клетки со всем его генетическим материалом в яйцеклетку, способную развиться в эмбрион. Биолог взял у головастика клетку кишечника, выделил клеточное ядро, поместил его в заранее опустошенную яйцеклетку другой лягушки — и стал надеяться, что получившийся эмбрион начнет делиться, как обычно. Так и произошло. На свет родился головастик, генетически идентичный тому, у которого Гёрдон брал кишечную клетку. Стало ясно, что обычные соматические клетки вполне подходят для клонирования.
Технология получила название somatic cell nucleus transfer, то есть перенос ядер соматических клеток. Сегодня SCNT — самый распространенный метод клонирования, который позволяет за один раз создать больше идентичных особей, чем разделение эмбриона. Ученые берут у животного-донора клетку, извлекают из нее ядро с ДНК и подсаживают это ядро в яйцеклетку другой особи, вычищенную от собственной ДНК. Чтобы всё прошло гладко (ядро встроилось в чужеродную клетку и запустился процесс формирования эмбриона), ученые искусственно стимулируют яйцеклетку химикатами или электрическим разрядом. Если эмбрион успешно проходит ранние стадии развития в пробирке, его помещают в утробу суррогатной самки, где он созревает вплоть до момента рождения. Таким образом на свет появляется генетический клон животного.
Овечка Долли и другие
После прорывного эксперимента Гёрдона прошло еще почти 40 лет, прежде чем биологам удалось повторить его на млекопитающих. Да, технология SCNT позволила ученым создавать зародышей кроликов, овец и коров, но только используя эмбриональные клетки, которые и так предрасположены к эмбриональному развитию. Однако такая техника, опять же, не позволяет сделать клон взрослой особи с уже известными и желаемыми характеристиками. Клонировать эмбрион означает клонировать вслепую, не зная, какими качествами или окрасом будет обладать клон.
В 1996 году мир потрясла история шотландской овечки Долли, первого млекопитающего, клонированного из самой обычной клетки, взятой с вымени взрослой овцы. Донором яйцеклетки и суррогатной матерью послужила шотландская черноголовая овца, но Долли, как и ожидалось, стала точной копией донора ДНК — 6-летней овцы породы финский дорсет. Долли прославилась на весь мир, а сам факт ее существования стал важнейшим научным достижением, которое, наконец, привлекло внимание к клонированию.
Для получения Долли шотландским биологам пришлось решить еще одну генетическую задачку. В отличие от взрослых клеток, клетки зародыша на ранней стадии развития максимально «гибкие»: в этот период идет активация генома, и эмбриональные клетки готовы превратиться в любую ткань будущего организма (кожную, мышечную, нервную и т. д.). Вскоре этот процесс завершается, и большинство клеток дифференцируются, то есть обретают свою профильную функцию. Клетка из вымени овцы, которую использовали для создания Долли, как и большинство клеток взрослого организма, была окончательно и бесповоротно дифференцированной — то есть неспособной развиться во что-то другое.
Шотландские ученые решили перепрограммировать ее обратно в состояние эмбриональной стволовой клетки, а затем — как обычно: выделить ядро, спаять с пустой донорской яйцеклеткой и подсадить в матку к суррогатной самке. Кейс овечки Долли прогремел именно благодаря этому:
ученые впервые доказали, что зрелую, определившуюся со своей функцией клетку можно вернуть в гибкое эмбриональное состояние — и она снова станет строительным материалом для развития организма.
С тех пор, используя технологию SCNT и обычные клетки, ученые клонировали кошек, собак, кроликов, лошадей, оленей, верблюдов, быков, волков и других млекопитающих. В 2004 году им даже удалось создать клона мыши, перепрограммировав ее обонятельный нейрон, — одну из так называемых терминально дифференцированных клеток, то есть навсегда утративших способность меняться и даже делиться. Эти клетки проходят полную и, как раньше считалось, необратимую клеточную специализацию. Но опыт показал, что даже такие «закоренелые» клетки, как нейроны, могут стать отправной точкой клонирования: ученым удалось вернуть их в клеточный цикл и заставить их вести себя как эмбриональные.
Поддержать независимую журналистику
Макаки-крабоеды и макаки-резус
Технически самым сложным было и остается клонирование приматов — самых высокоорганизованных млекопитающих и наших ближайших генетических сородичей. Попытки сделать это начались почти тридцать лет назад. В 1997 году, через год после рождения овечки Долли, на свет появились два первых клона макаки-резус: на тот момент американские ученые смогли использовать в качестве донорского материала только ранние зародышевые клетки. Зато выяснилось, что приматы в принципе поддаются клонированию.
В 2017 году в Китае сумели клонировать другую обезьяну, макаку-крабоеда. На этот раз в процедуре SCNT были использованы клетки соединительной ткани (фибробласты), взятые у детеныша макаки на 61 день развития плода — сразу по окончании эмбрионального периода. Это, конечно, не взрослые дифференцированные клетки, но и не «готовые на всё» зародышевые. Сегодня именно клетки плода чаще всего используются как отправной материал для клонирования млекопитающих: они повышают эффективность опытов, но при этом ведут себя во многом аналогично соматическим клеткам. Китайские ученые пробовали клонировать и обычные клетки, но из 180 получившихся эмбрионов только два детеныша дожили до рождения — и погибли чуть больше чем через сутки.

Чжун Чжун (ZZ) и Хуа Хуа (HH), две макаки-крабоеда, появившихся на свет в результате клонирования в 2017 году. На снимках, сделанных учеными, клонам 20 и 34 дня соответственно. Фото: cell.com
Тем не менее исследователи сделали важный прорыв в SCNT-клонировании. Им удалось оптимизировать и сам метод пересадки ядра, и процедуру его перепрограммирования. В результате ДНК донорской клетки с большей готовностью переключалось на эмбриональную программу, зародыши лучше развивались, а суррогатным самкам стало легче вынашивать их до рождения. Следующий шаг в этом направлении сделали там же, в Китае: в 2024 году мир узнал, что местные генетики успешно клонировали макаку-резус.
«Всё получилось благодаря тому, что мы устранили проблемы, возникающие как перед имплантацией эмбриона в матку, так и в постимплантационный период», — говорят руководители исследования Фалонг Лу (Falong Lu), Чжень Лю (Zhen Liu) и Цян Сунь (Qiang Sun) из Центра передового опыта в области наук о мозге и умных технологий и из Института генетики и биологии развития, двух государственных организаций, аффилированных с Китайской академией наук. Чжень Лю и Цян Сунь уже участвовали в клонировании макаки-крабоеда в 2017 году и во многом привнесли свой опыт в новое исследование. Но понимание механизмов перепрограммирования ДНК оставалось ограниченным, а эффективность испытаний — низкой.
Первым делом китайские генетики выяснили, что при клонировании млекопитающих плод чаще всего погибает во время имплантации или сразу после. Это происходит из-за дефектов перепрограммирования:
экспрессия генов идет со сбоями, что приводит к аномалиям и задержкам эмбрионального развития, в частности, к нарушениям в трофобласте — внешнем слое эмбриона, из которого формируется плацента. Плацента будет снабжать растущий плод кислородом и питательными веществами, поэтому правильное развитие трофобласта играет ключевую роль при клонировании. Похоже, Лу, Лю и Сунь решили эту проблему.
По их словам, им впервые удалось определить, какие именно дефекты происходят в клетках трофобласта, и разработать метод его замены. Взяв у 62-дневного плода макаки-резус донорский фибробласт, ученые уже привычным способом создали из него эмбрион. Затем с помощью лазера извлекли из эмбриона только внутреннюю клеточную массу (ту, из которой будет развиваться тело) и пересадили ее внутрь другого, опустошенного зародыша, от которого остался только внешний слой клеток. Таким образом исследователи отбраковали потенциально дефектную оболочку эмбриона, спаяв его со здоровым трофобластом, — тот должен был обеспечить нормальное плацентарное развитие.
Так и произошло. На свет появился первый клонированный с помощью SCNT самец макаки-резус. Сегодня ему уже больше трех лет, так что эксперимент можно смело назвать успешным. Но можно ли говорить об успехах клонирования вообще, имея на руках только одну удачную «копию»? «Да. Мы убеждены в том, что даже одна копия демонстрирует успехи в клонировании макак-резус», — считают китайские генетики. В конце концов, раньше такого никому не удавалось.
Альцгеймер, депрессия и лечебное молоко
Научный ажиотаж вокруг клонирования этих макак связан с тем, что ученые-медики предпочитают по возможности работать именно с ними — из-за генетической и физиологической близости к Homo Sapiens. «Нечеловекообразные приматы, в том числе макаки-резусы и макаки-крабоеды, нам жизненно необходимы, — говорят Фалонг Лу, Чжень Лю и Цян Сунь. — Их широко используют как лабораторных животных в когнитивных и биомедицинских исследованиях». Изучение клонированных животных вообще крайне важно для понимания таких процессов как зародышевое развитие, старение и возникновение болезней. А приматы — идеальные модели для исследования человеческих заболеваний.
Макаки участвуют в изучении инфекций и иммунного ответа, аутизма, болезней Паркинсона, Альцгеймера и Хантингтона, некоторых видов рака. И большую роль здесь играет генная инженерия.
Дело в том, что фибробласты плода хорошо поддаются редактированию генома, а еще их, в отличие от эмбриональных клеток, можно выращивать в лаборатории. Это позволяет ученым проводить генетические модификации прямо в чашке Петри и создавать столько клонов, сколько нужно. Сочетание двух технологий — генного редактирования и SCNT-клонирования — помогло бы создать из нечеловекообразных приматов почти идеальных подопытных для изучения людских болезней и лекарств от них. «Например, уже были случаи тестирования болезни Хантингтона на трансгенных обезьянах или болезни Паркинсона на обезьянах с отредактированным геномом, — говорят китайские генетики. — Если одна из таких обезьян будет признана идеальной моделью для имитации болезни Паркинсона или Альцгеймера, мы можем взять ее соматические клетки и с помощью SCNT за короткое время получить нескольких генетически идентичных потомков».
Пример — пять клонов макаки со специально нарушенным циркадным ритмом, родившихся в Китае в 2019 году под наблюдением другой команды ученых. С помощью методики изменения ДНК (CRISPR) у макаки-донора была подавлена экспрессия циркадных генов; затем из этого отредактированного генома создали несколько идентичных эмбрионов. На свет родились пять макак с теми же симптомами, которые у человека связывают с нарушением циркадного ритма: расстройством сна, повышенной тревожностью, депрессией и даже шизофренией. Известно, что циркадные нарушения также могут провоцировать сахарный диабет, рак и нейродегенеративные заболевания, — это и будут изучать генетики, вызвавшие у своих «моделей» психические патологии.
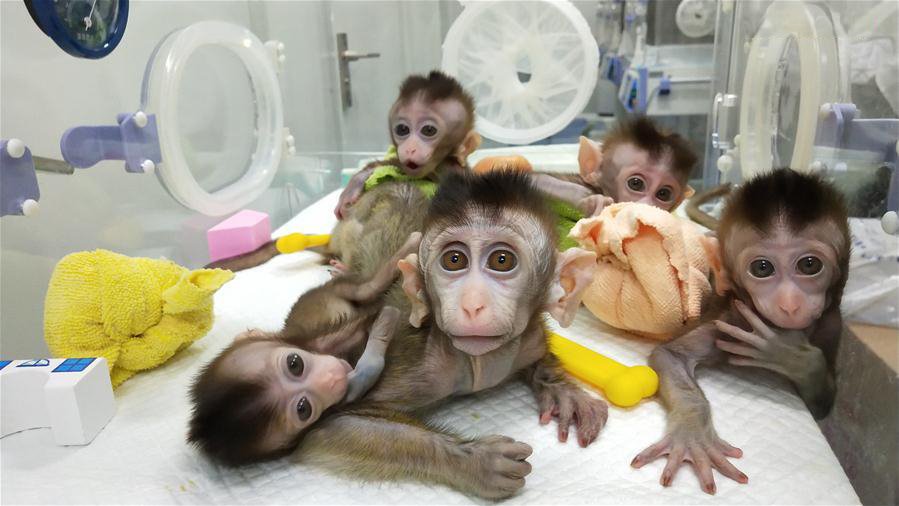
Пять клонированных обезьян с нарушениями циркадного ритма, родившиеся в Институте неврологии Китайской академии наук в 2019 году. Фото: Institute of Neuroscience of Chinese Academy of Sciences
Вообще идея активно использовать клонированных животных пришла нам почти сразу. Те же шотландские биологи, создавшие Долли, намеревались наладить производство лекарственного молока для больных гемофилией, муковисцидозом и другими тяжелыми заболеваниями. Им удалось дополнить ДНК из клетки кожи овцы человеческим геном, который повышает свертываемость крови. Затем с помощью SCNT они внедрили отредактированный геном в зародыш овцы — и в 1997 году родилась Полли, в молоке которой содержался человеческий белок свертывания крови.
Ученые рассчитывали, что если дать таким овцам и коровам размножаться, они сформируют поголовье с целебным молоком, которое станет натуральным источником препаратов от гемофилии.
Пока что вокруг нас не пасутся стада генномодифицированного скота, но эксперимент с Полли показал, что животные могут обладать терапевтическим потенциалом. Сегодня речь идет даже о том, чтобы производить с их помощью человеческие антитела против инфекционных болезней и рака.
Еще одно применение клонированных животных в науке — тестирование новых лекарств и методов терапии. Если у обычных подопытных реакция на препараты разнится из-за особенностей организма, генетически идентичные особи должны реагировать одинаково, давая ученым более ясную картину. Исследователи и так стараются брать для опытов максимально близких животных-родственников, но в случае с приматами это гораздо сложнее, чем с мышами и кроликами. «При традиционном разведении может понадобиться больше 10 лет, чтобы получить нужное число особей, — говорят Лу, Лю и Сунь, клонировавшие макаку-резус. — У макак преимущественно одноплодные беременности, а на половое созревание уходит от трех до пяти лет. При этом каждый из детенышей будет всё равно немного генетически отличаться от остальных».
SCNT-клонирование позволяет значительно ускорить процесс.
Воскресить питомца или мамонта
Вторая очевидная область применения клонирования — сельское хозяйство. Как и в случае с растениями, разведение животных «почкованием» сулит рост качества и количества пищевых продуктов. Зачем ждать результатов селекции, если можно быстро клонировать коров, дающих рекордное количество молока, и свиней с высоким убойным выходом или диетическим мясом? Точно так же можно вытеснить из породы определенные заболевания, если «копировать» только здоровых особей. Например, именно благодаря клонированию удалось сохранить в популяции американских быков ценный геном с устойчивостью к бруцеллезу, туберкулезу и сальмонелле. В 2008 году американское Управление по санитарному надзору за качеством пищевых продуктов и медикаментов постановило, что мясо и молоко клонированных животных — коров, коз, свиней — являются безопасными и могут употребляться в пищу. Европейское агентство по безопасности продуктов питания пока не заняло четкую позицию по этому вопросу.
Клонирование животных не сводится только к получению желаемых сельскохозяйственных характеристик. С его помощью выводят образцовых боевых быков, выставочных и скаковых лошадей. Последних, например, кастрируют в раннем возрасте, что навсегда лишает их возможности размножаться. Теперь благодаря клонированию победители скачек всё-таки смогут передать потомству свой чемпионский геном. Наконец, есть другая категория животных, которых нам очень хотелось бы держать при себе и воспроизводить: домашние питомцы.
Сегодня частные фирмы в США, Китае, Южной Корее уже предлагают хозяевам «воскресить» своих умерших любимцев.
Процесс это непростой: на клонирование собаки уходит около восьми месяцев, кошки — около года. Услуга стоит десятки тысяч долларов, но на спрос это не влияет: компании клонируют сотни домашних животных в год.
Если можно воскресить питомца, почему не попробовать воскресить вымирающие или даже вымершие виды, подумали ученые в конце 1990-х. После удачных экспериментов с крупными млекопитающими это казалось заманчивой идеей. Проблема заключалась лишь в том, чтобы найти близкородственных животных, которые могли бы послужить донорами яйцеклеток и суррогатными матерями. В 2000 году на свет появился первый межвидовой клон: ДНК гаура (быка, находящегося под угрозой исчезновения) поместили в яйцеклетку обычной коровы, которая и выносила детеныша; тот погиб через несколько дней после рождения. На следующий год ученым повезло больше: с помощью домашней овцы им удалось создать клона европейского муфлона, исчезающего вида диких баранов. С тех пор эксперименты продолжились. Дикую степную кошку клонировали с помощью обычной, двугорбого верблюда — с помощью одногорбого, а пиренейского горного козла букардо — с помощью домашней козы. Букардо стал первым полностью вымершим видом, который вернули к жизни. Правда, ненадолго: клон умер спустя несколько минут после рождения.
В случае букардо и других редких животных донорскую ДНК часто берут из замороженных клеток, которые принадлежали последним особям, жившим в зоопарках и заповедниках. Именно это дает надежду на восстановление популяции. Например, в 2020 году ученым в США удалось успешно клонировать американского черноногого хорька, чьи клетки хранились в жидком азоте более 30 лет. Авторы эксперимента утверждают, что эта ДНК может внести в оставшуюся на Земле небольшую популяцию в 400–500 особей так необходимое ей генетическое разнообразие. Дело в том, что в конце XX века американские хорьки находились на грани вымирания; последних из них пришлось отловить и разводить в неволе, что привело к большому количеству близкородственных скрещиваний и ослабило популяцию.
Та же надежда на недавно клонированную лошадь Пржевальского; ее геном происходит из клеток, замороженных в 1980 году. Как и хорьки, этот вид когда-то вымер в дикой природе, но был сохранен благодаря интенсивному разведению в заповедниках. Возрожденную популяцию затем выпустили на вольные луга Китая и Монголии — заново осваивать естественную среду обитания.
Проблема в том, что почти все ныне живущие особи происходят от одних и тех же 12 диких лошадей Пржевальского, когда-то спасенных от вымирания. Внедрение в генофонд свежей ДНК помогло бы виду успешнее пройти через это «бутылочное горлышко».
Самым амбициозным проектом на сегодняшний день кажется идея возродить шерстистого мамонта, который на протяжении сотен тысячи лет был важным элементом арктической экосистемы и бродил по северу современной России, Европы и Северной Америки. Четыре тысячи лет назад мамонт вымер, но глядя на успехи клонирования и генной инженерии, американские ученые задумались о том, чтобы его оживить. Пока что ни одни раскопки не подарили нам цельной ДНК мамонта, но у нас имеются ее фрагменты.
План в том, чтобы внедрить мамонтовые гены в геном индийского слона, подсадить его в оплодотворенную слоновью яйцеклетку и попробовать создать трансгенного «арктического слона».
В случае успеха он мог бы заселить Крайний Север, потихоньку восстанавливая тундру и борясь с изменением климата: возвращение крупных травоядных животных в Заполярье может восстановить его пастбищные экосистемы и замедлить таяние вечной мерзлоты.
Животные-доноры
Клонирование целого животного является только одним из типов искусственного клонирования. Гораздо чаще ученые копируют отдельные гены, сегменты ДНК, клетки и ткани, например, для их изучения. В некоторых странах существует также терапевтическое клонирование. Оно предполагает клонирование ДНК животного или человека вплоть до создания эмбриона в пробирке, но с единственной целью — разобрать его на стволовые клетки. Поскольку на ранних этапах развития клетки зародыша еще не дифференцированы и готовы превратиться в любой «кирпичик» в организме, из них можно вырастить ткани на замену поврежденным или больным. При этом иммунная система реципиента не должна отторгать такие ткани, ведь они созданы из его собственных эмбриональных стволовых клеток. Их собирают в первые несколько дней развития эмбриона, что, кстати, приводит к его разрушению.
Теоретически из таких клеток можно вырастить целый орган для трансплантации. Пока же возможностей клонирования хватает только на то, чтобы — в тандеме с генной инженерией — подготовить органы животных для пересадки людям. Такие эксперименты активно идут в США: с помощью технологий CRISPR и SCNT ученым удается находить и «выключить» у свиней гены, которые делают их клетки несовместимыми с нашими. Так, в 2022 году американские хирурги пересадили неизлечимо больному мужчине сердце генномодифицированной свиньи с 10 «очеловеченными» генами, но он прожил с ним лишь два месяца. В 2024 году там же, в США, мужчине пересадили почку свиньи с геномом, отредактированным для большей совместимости, но и он умер через полтора месяца. Тем не менее ученые не теряют надежды разводить генетически идентичных свиней на органы.
Идея использовать животных для трансплантации вызывает энтузиазм далеко не у всех. В 2022 году зоозащитники осудили проект немецких исследователей по клонированию и выращиванию генномодифицированных свиней, которые должны служить донорами сердца для людей. «Животные не должны выступать в качестве запчастей для человека», — сказали Reuters в немецком отделении Animal Welfare Association. Мало того, что проект низводит свиней до фабрик по производству органов, в нём задействованы еще и приматы: прежде чем начать клинические испытания на людях, ученые тестируют пересадку свиных сердец на бабуинах, многие из которых умирают в мучениях.
Клонирование самих приматов тоже вызывает критику борцов за права животных.
«На мой взгляд, клонирование допустимо только с разрешения самого индивида, чью копию планируется сделать. Понятно, что на текущем этапе развития получить подобное разрешение мы можем только у человека,
— считает Юрий Корецких, исполнительный директор «Альянса защитников животных». — В случае с растениями и одноклеточными живыми организмами я думаю, что подобные эксперименты допустимы, так как пока нет достоверных подтверждений того, что они способны испытывать страдания и боль». Но эксперименты с высокоразвитыми животными — другое дело. «Приматы это разумные и чувствительные животные, а не просто инструменты для исследования», — приводит BBC позицию британского Королевского общества защиты животных от жестокого обращения. Зоозащитники указывают на страдания и стресс, которые часто переживают подопытные, а еще называют клонирование крайне неэффективной технологией с очень низкими показателями успеха.
Зоозащитники против
Дело в том, что ради одного успешного клона ученые жертвуют сотнями потенциальных жизней. Прежде всего для забора донорской ДНК плод приходится абортировать на втором месяце беременности. Риск смерти и далее сопровождает все стадии SCNT: от начала деления яйцеклетки до родов. Первый успешный клон, овечка Долли, был результатом одной из 277 попыток; остальные закончились гибелью эмбрионов или выкидышами. С тех пор результативность клонирования не сильно повысилась. Тем же китайским ученым, клонировавшим макаку-резус, пришлось создать 113 эмбрионов и провести через беременность множество суррогатных самок — всё ради одного живорождения.
Фалонг Лу, Чжень Лю и Цян Сунь подчеркивают, что все процедуры, которым подвергаются животные в их лаборатории, согласованы со всевозможными китайскими институтами и одобрены как несущие пользу обществу, а также «строго соответствуют этическим принципам международного сообщества».
«Мы пересадили 11 реконструированных эмбрионов и получили одну живорожденную клонированную макаку-резус. Сейчас ей три с половиной года, и она здорова. Мы считаем, что ответственно подошли к исследованию»,
— говорят генетики.
Показатели выживаемости млекопитающих при методе SCNT действительно низкие: от 1% до 3% — для большинства видов и 5–20% — для крупного рогатого скота. Детеныши часто рождаются мертвыми или умирают в течение нескольких дней после родов, а те, кто выживает, обычно мучаются от проблем с дыханием и иммунитетом, опухолей, нарушений в жизненно важных органах: мозге, сердце, печени. Клоны редко доживают до зрелого возраста, а также подвержены преждевременному старению. Весь этот «сопутствующий ущерб» можно было бы принять, если бы клонирование приносило ощутимую пользу. «Это исследование не сулит никакого непосредственного применения в ближайшее время, — так в Королевском обществе защиты животных от жестокого обращения комментируют клонирование макаки-резус. — Прежде чем его можно будет применить в реальной жизни, должны пройти годы. И скорее всего, для разработки этих технологий потребуется больше «моделей» животных».
«Я не поддерживаю клонирование животных ровно по тем же причинам, почему большинство людей не поддерживает клонирование человека, — говорит Юрий Корецких. — На начальных этапах развития этой технологии неизбежны неудачные эксперименты, которые приведут к страданиям животных. Мы не имеем морального права приносить чью-либо жизнь в жертву — ради науки, медицины и любой другой цели — без его согласия, пусть даже и во имя спасения большего количества других жизней».
Гены и среда
Несмотря на постоянное развитие науки, пока клонирование животных — это чаще всего единичные случаи в экспериментальном формате. SCNT — долгая и дорогая технология (в Китае создание клона примата обходится в десятки тысяч долларов). В том числе поэтому человечеству еще далеко до практического применения клонов, например, в животноводстве: пока традиционные методы разведения гораздо дешевле и проще. Долгим будет и путь морального принятия обществом таких реалий, как продажа и потребление продуктов из клонированного скота. На данный момент Европейская группа по вопросам этики в науке и новых технологиях «не уверена, что клонирование животных для производства продовольствия этически оправдано», учитывая проблемы со здоровьем и страдания подопытных.
Что касается спасения исчезающих и редких видов, многие эксперты сомневаются, что путем клонирования можно создать что-то, кроме генетически однородной популяции.
Вымирающие виды животных страдают от нехватки разнообразия в генофонде, и копирование особей никак не помогает решить эту проблему. Особенно когда речь идет об окончательно вымерших видах, которых предлагается вернуть из забвения.
Генетикам сильно повезет, если археологи достанут им хотя бы несколько полных ДНК, но этого и близко недостаточно, чтобы воссоздать целый вид. Тем более если, как в случае с горным козлом букардо, образцы генома принадлежат только самкам: создать клон мужской особи для продолжения рода представляется невозможным.
С клонированием домашних животных тоже не всё так просто. Очевидно, что хозяевами движет тоска по умершим питомцам и желание получить их копии, но клоны далеко не всегда выглядят и ведут себя в точности так, как оригинал. Несмотря на совпадающие ДНК, характер, поведение, окрас шерсти и другие черты животных могут различаться, ведь на формирование организма сильно влияют и внешние условия. К примеру, котенок, родившийся в 2001 году и ставший первым кошачьим клоном, мало чем походил на «оригинал». Оба животных имели мозаичный трехцветный окрас, но у каждого из них пятна расположились по-своему.

Слева кот-донор, в центре котенок-клон, справа — выросший клон. Фото: Texas A&M Veterinary Medicine & Biomedical Sciences
Оказалось, что генетические инструкции, по которым строится организм, оставляют широкий простор для развития личности и индивидуальных характеристик животного, и человек далек от того, чтобы контролировать это развитие. Сегодня мы можем в точности скопировать ДНК, но в остальном можно рассчитывать, что животные-клоны будут похожи друг на друга лишь до той степени, до которой схожи, например, однояйцевые близнецы. Как говорила известный специалист по питанию и внутренним болезням Джудит Стерн, генетика заряжает пистолет, но курок спускает окружающая среда.


Комментариев нет:
Отправить комментарий